„Systemy CRISPR-Cas” w bakteriach i wirusach identyfikują i niszczą inwazyjne sekwencje wirusowe. Jest to bakteryjny i archeonowy układ odpornościowy chroniący przed infekcjami wirusowymi. W 2012 roku system CRISPR-Cas został uznany za Genom narzędzie do edycji. Od tego czasu opracowano szeroką gamę systemów CRISPR-Cas, które znalazły zastosowanie w takich obszarach jak terapia genowa, diagnostyka, badania i ulepszanie upraw. Jednakże obecnie dostępne systemy CRISPR-Cas mają ograniczone zastosowanie kliniczne ze względu na częste występowanie edycji niezgodnej z celem, nieoczekiwane mutacje DNA i problemy dziedziczne. Naukowcy ogłosili niedawno nowatorski system CRISPR-Cas, który może namierzać i niszczyć mRNA oraz Białka powiązane z różnymi chorobami genetycznymi, bez skutków ubocznych i problemów dziedzicznych. Jest to pierwszy system CRISPR-Cas, który się pokazał. Nazwany Craspase białko funkcja edycji. Jest to także pierwszy system, który może edytować zarówno RNA, jak i białko. Ponieważ Craspase pokonuje wiele ograniczeń istniejących systemów CRISPR-Cas, może zrewolucjonizować terapię genową, diagnostykę i monitorowanie, badania biomedyczne i poprawę upraw.
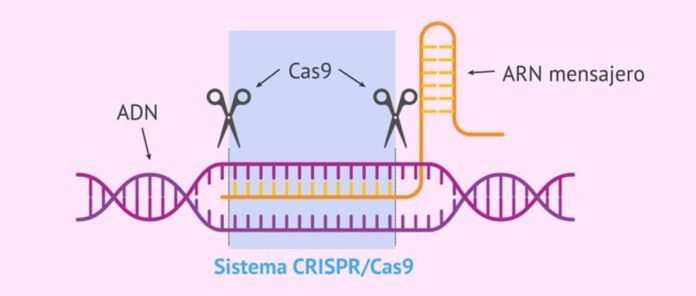
„System CRISPR-Cas” to naturalny układ odpornościowy bakterii i archeonów przeciwko infekcjom wirusowym, który identyfikuje, wiąże i degraduje sekwencje genu wirusa w celu ochrony. Składa się z dwóch części – bakteryjnego RNA transkrybowanego z genu wirusowego włączonego do genomu bakteryjnego po pierwszej infekcji (zwanego CRISPR, identyfikuje docelowe sekwencje atakujących genów wirusowych) i powiązanego niszczyciela białko zwane „powiązanymi z CRISPR”. białko (Cas)”, który wiąże i degraduje zidentyfikowane sekwencje genu wirusa w celu ochrony bakterii przed wirusami.
CrisPER oznacza „skupione, regularnie przeplatane krótkimi powtórzeniami palindromowymi”. Jest to transkrybowany bakteryjny RNA charakteryzujący się palindromowymi powtórzeniami.
Powtórzenia palindromiczne (CRISPR) zostały po raz pierwszy odkryte w sekwencjach E. coli w 1987 r. W 1995 r. Francisco Mojica zaobserwował podobne struktury u archeonów i to on jako pierwszy pomyślał o nich jako o części układu odpornościowego bakterii i archeonów. W 2008 roku po raz pierwszy wykazano eksperymentalnie, że celem układu odpornościowego bakterii i archeonów jest obcy DNA, a nie mRNA. Mechanizm identyfikacji i degradacji sekwencji wirusowych sugeruje, że takie systemy mogą znaleźć zastosowanie jako narzędzie edycja genomu. Od momentu uznania za narzędzie do edycji genomu w 2012 r., system CRISPR–Cas przeszedł bardzo długą drogę jako ugruntowany standard edycja gen system i znalazł szerokie zastosowanie w biomedycynie, rolnictwie, przemyśle farmaceutycznym, w tym w klinicznej terapii genowej1,2.
Szeroka gama CRISPR-Systemy Cas są już zidentyfikowane i obecnie dostępne do monitorowania i edycji sekwencji DNA/RNA na potrzeby badań, badań przesiewowych leków, diagnostyki i leczenia. Obecne systemy CRISPR/Cas dzielą się na 2 klasy (klasa 1 i 2) oraz sześć typów (typ I do XI). Systemy klasy 1 mają wiele Cas Białka które muszą utworzyć kompleks funkcjonalny, aby wiązać swoje cele i działać na nie. Z drugiej strony systemy klasy 2 mają tylko jedną dużą Cas białko do wiązania i degradacji sekwencji docelowych, co czyni systemy klasy 2 łatwiejszymi w użyciu. Powszechnie stosowane systemy klasy 2 to Cas 9 typ II, Cas13 typ VI i Cas12 typ V. Systemy te mogą powodować niepożądane skutki uboczne, tj. wpływ poza cel i cytotoksyczność3,5.
Terapie genowe oparte na obecnych systemach CRISPR-Cas mają ograniczone zastosowanie kliniczne ze względu na częste występowanie edycji poza celem, nieoczekiwanych mutacji DNA, w tym delecji dużych fragmentów DNA i dużych wariantów strukturalnych DNA zarówno w miejscach docelowych, jak i poza celem, co prowadzi do śmierci komórek i inne dziedziczne problemy.
Kraspaza (lub kaspaza kierowana przez CRISPR)
Naukowcy niedawno ogłosili nowy system CRISPER-Cas, który jest systemem Cas2-7 klasy 11 typu III-E powiązanym z kaspazą białko stąd nazwa Kraspaza lub kaspaza kierowana przez CRISPR 5 (Kaspazy to proteazy cysteinowe, które odgrywają kluczową rolę w apoptozie w rozbijaniu struktur komórkowych). Ma potencjalne zastosowania w takich obszarach, jak terapia genowa i diagnostyka. Craspaza jest kierowana przez RNA i ukierunkowana na RNA i nie angażuje się w sekwencje DNA. Może celować i niszczyć mRNA i Białka powiązane z różnymi chorobami genetycznymi, bez wpływu na cel. Zatem eliminacja genów związanych z chorobami jest możliwa poprzez cięcie na poziomie mRNA lub białka. Ponadto, po połączeniu z konkretnym enzymem, kraspazę można również stosować do modyfikowania funkcji białek. Kiedy funkcje RNazy i proteazy zostaną usunięte, Kraspaza zostaje dezaktywowana (dKraspaza). Nie ma funkcji cięcia, ale wiąże się z sekwencjami RNA i białek. Dlatego dCraspase można stosować w diagnostyce i obrazowaniu w celu monitorowania i diagnozowania chorób lub wirusów.
Craspase to pierwszy system CRISPR-Cas, który wykazuje funkcję edycji białek. Jest to także pierwszy system, który może edytować zarówno RNA, jak i białko. Jego edycja gen Funkcja ta występuje przy minimalnych efektach odbiegających od docelowych i nie ma problemów dziedzicznych. W związku z tym kraspaza będzie prawdopodobnie bezpieczniejsza w zastosowaniu klinicznym i terapeutycznym niż inne obecnie dostępne systemy CRISPR-Cas 4,5.
Ponieważ Craspase pokonuje wiele ograniczeń istniejących systemów CRISPR-Cas, może zrewolucjonizować terapię genową, diagnostykę i monitorowanie, badania biomedyczne i ulepszanie upraw. Potrzebne są dalsze badania, aby opracować niezawodny system dostarczania, który precyzyjnie celował w geny powodujące choroby w komórkach, zanim udowodni bezpieczeństwo i skuteczność w badaniach klinicznych.
***
Referencje:
- Gostimskaya, I. CRISPR – Cas9: historia jego odkrycia i względy etyczne dotyczące jego wykorzystania w edycji genomu. Biochemia Moskwa 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- Chao Li i wsp 2022. Narzędzia obliczeniowe i zasoby do edycji genomu CRISPR / Cas. Genomika, proteomika i bioinformatyka. Dostępne online 24 marca 2022 r. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. et al. Systemy CRISPR-Cas nakierowane na RNA. Nat Rev Microbiol 21, 21–34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Chunyi Hu i wsp 2022. Kraspaza jest proteazą aktywowaną przez RNA kierowaną przez CRISPR. Nauka. 25 sierpnia 2022 r., tom 377, wydanie 6612. s. 1278-1285. DOI: https://doi.org/10.1126/science.add5064
- Huo, G., Shepherd, J. & Pan, X. Craspase: nowatorski edytor podwójnych genów CRISPR / Cas. Genomika funkcjonalna i integracyjna 23, 98 (2023). Opublikowano: 23 marca 2023 r. DOI: https://doi.org/10.1007/s10142-023-01024-0
***